明確で簡潔な規制文書は、医薬品開発プログラムの成功に不可欠です。当社の優秀なライターチームには、医薬品開発プロセスの全段階をカバーする博士、薬学博士、医学博士が揃っています。
お客様の声(一部抜粋)
「当社の文書に対するサターラのメディカルライターのコメントは非常に有益で、かつ彼らによる修正は常に的確です。サターラのチームは承認申請に向けたeCTDモジュールの作成業務において、本当に素晴らしいサポートを提供してくれました。非の打ちどころがなく、一貫性のある文書を完成させることができました。」– Director、In Vivo Pharmacology、Toxicology & DMPK、EUを拠点とする製薬企業
規制対応およびメディカルライティングに
おける突出した成功実績
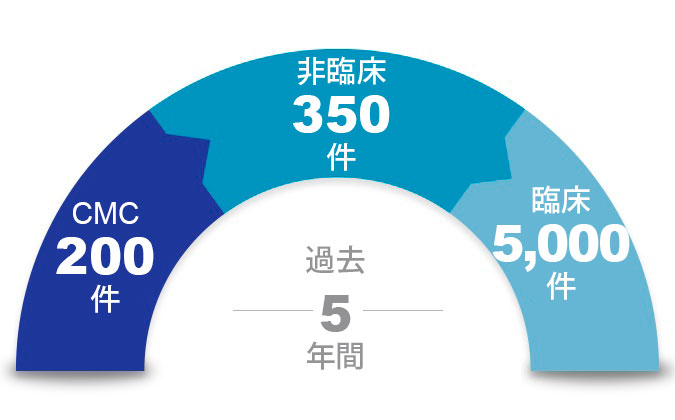
サターラは、医薬品開発のライフサイクル全体を通じて必要とされる臨床、CMC、非臨床文書のオーサリングサービスを提供しています:
- 治験責任医師のパンフレットと最新情報
- 臨床試験プロトコルと修正
- 臨床試験レポート
- ブリーフィング資料、ミーティング依頼、情報提供依頼
- 新薬臨床試験開始申請(IND)、製造販売承認申請(MAA)、新薬承認申請(NDA)のすべてのCTDモジュール1,2, 3, 4, 5 コンポーネント
- 小児試験計画/小児治験計画
- 患者ナラティブと安全性報告
- 年次報告書/DSUR/PBRER
- 臨床評価報告書(CER)
- 一般向け臨床試験結果の要約 (平易な要約)、インフォームド・コンセント/同意書、一般向け臨床試験概要書
世界各国の主要な規制当局へ提出する書類は整っていますか?
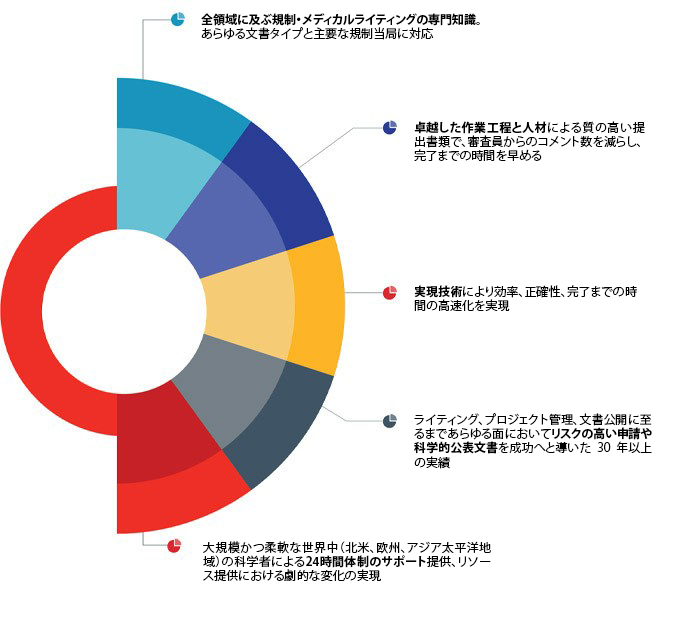
医薬品開発計画は多くの困難を克服し、多大な投資を費やした後、ようやく承認申請に至ります。今度は、申請文書について、医薬品開発の全ライフサイクルにわたるメディカルライティングの専門知識が必要となります。サターラは、CMC、非臨床、臨床の専門知識を必要とする新薬臨床試験開始申請、NDA、MAAから薬事承認申請のための専門的なコンサルティングサービスを提供しています。最も重要なことは、貴社の申請プログラムには、サターラ・レギュラトリー・ライティングが提供する、連携したテクノロジー対応の専門知識が必要だということです。
サターラのレギュラトリーライターは、すべての申請文書タイプにおいて、技術的および治療的な深い専門知識を提供することで、毎回、期限内に申請文書を作成し、成功に導きます。
提出書類を迅速に作成するための規制文書作成サービス
博士、医学博士、薬学博士、科学者、看護師など、あらゆる機能分野(文書品質、CMC、非臨床、臨床、薬事)に精通した優秀なライター陣が、世界最大手の製薬会社をサポートしています。製薬業界において最高水準を誇るSOPによって優れた文書品質を保証します。専任の品質管理チームとライティングチームの効果的な連携を通して作成される文書は、レビューのプロセスを最短化し、承認申請完了までの期間を短縮します。
サターラのメディカルライターおよびレギュラトリーライターは、主要なオピニオンリーダーとして、DIA Annual、AMWA's Medical Writing and Communication Conference、EMWA's Medical Writing Conference などの主要な業界イベントで定期的に講演を行っています。
Regulatory Writer Acceleration Residency (RWAR)
RWARは、メディカルライターに興味のある方のためのユニークな機会です。さまざまなレギュラトリーライティングの分野における成功実績を持つチームから学びましょう。
研修中には、仲間とともに2年間のカリキュラムを開始し、レギュラトリーライティングのプロジェクトを率いるうえで必要なスキルを学びつつ、医薬品開発の推進文書に触れる量を増やしていきます。サービス機関であるサターラのプログラムでは、入社後1年間で、スポンサーと直接仕事をするために必要なスキルを身につけることができます。臨床、非臨床、および市販後調査の分野に機会があります。
有力な候補者は、規制文書の執筆作業を主導することへの移行を加速させる、指導者主導のトレーニングプログラムに参加する機会があります。
